Виділення гена — рецептора етилену

Генетичні досліди показали, що у арабідопсиса за рецепторним білком ETR1 в системі переносу етиленового сигналу повинен бути розташований білок CTR1, блокуючий в нормі проходження сигналу. Мутація за його гену ctr1 призводить до морфологічних змін у арабідопсису, які могли б виникнути при постійному включенні етиленової програми. Цей білок репресує етиленові програми у дикого типу. Вивчення… Читати ще >
Виділення гена — рецептора етилену (реферат, курсова, диплом, контрольна)
Дослідження, проведені М. Холом (Великобрітанія) і Е. Сіслером (США), показали, що:
- 1) клітинам рослин притаманна здатність звернимо пов’язувати етилен,
- 2) інгібування цього процесу призводить до придушення типових реакцій рослин на етилен,
- 3) етілензв'язуючий білок знаходиться в клітинній мембрані. Дослідження нечутливих до етилену мутантів арабідопсису підтвердило, що у них різко знижене зв’язування етилену. Це дозволяло очікувати, що у мутантів пошкоджений ген рецептора цього гормону. Великий прогрес був досягнутий в результаті робіт деяких груп американських дослідників, включаючи А. Блікер, Дж. Еккера, Х. Клея.
Один з генів, що викликають нечутливість до етилену (etr1), виділений і клоновани А. Блікером. Потім ген був введений в клітини дріжджів, в яких і було здійснено синтез кодованого геном etr1 білка. Цей білок ETR1 надавав клітинам дріжджів здатність зв’язувати етилен, яка була відсутня у контрольних дріжджів. Зв’язування відбувалося з тієї ж кінетикою, що в клітинах рослин, і пригнічувалось тими ж інгібіторами. Все це дозволяло зробити висновок, що в дріжджах синтезований рецептор етилену. Він являє собою білок 79 kD, який утворює димер (147 kD), дві субодиниці якого з'єднані дисульфідним містком. Установлення нуклеотидної послідовності гена etr1 дозволило вивести з неї амінокислотну попослідовність кодованого їм білка ETR1. Білок виявив високу гомологію з бактеріальною гістидиновою протеїнкіназою, що входить до складу бікомпонентної сигнальної системи бактерій. Вона називається бікомпонентною тому, що діє в два етапи і включає в себе два білка: сенсор і ефектор (рис. 7).
На першому етапі прийнятий сенсорною гістидил-протеїнкіназою сигнал збуджує активність ферменту і призводить до фосфорилювання в його молекулі всього одного гістидинового залишку, розташованого в строго певній ділянці молекули, високо консервативному у всіх гістидилових протеїнкіназ. На другому етапі функціонування бікомпонентної сигнальної системи фосфатна група передається з гістидинового залишку на залишок аспарагінової кислоти, розташованій у бактерій зазвичай в іншому білку. У результаті фосфорилювання він активується і набуває здатність регулювати активність генів, включаючи одні з них і вимикаючи інші. Таким шляхом здійснюється відповідь клітини на прийнятий сигнал. Гістидинова протеїнкіназ, яка входить до складу бікомпонентної сигнальної системи, широко поширена у бактерій і бере участь в їх реакціях на зміну осмотичних умов середовища, концентрації в ній необхідних метаболітів, в явищах хемотаксису і взаємодії з хозяїном. В еукаріотичних клітинах широко розповсюджені серинові і треонінові протеїнкінази, які фосфорилируют у білків певні серинові і треонінові залишки, і тирозинові протеїнкінази, фосфорилюють тирозинів залишок. Гістидинова протеїнкіназа вважалася специфічною для бактерій, проте вона виявлена також у дріжджів, де бере участь у відповіді на сольовий стрес, і у ссавців. Встановлена А. Блікером приналежність ETR1 арабідопсис до гістидинової протеїнкінази є першим сповіщенням про їх присутність у рослин.
Аналіз амінокислотної послідовності ETR1, виведеної з нуклеотидної послідовності його гена, виявляє в білку три різні частини (див. рис. 7).
Одна з них (розташована на N-кінці молекули) відрізняється високою гідрофобністю.Вона унікальна за своєю структурою, не має в банку даних аналогів з іншими білками. Ця частина молекули локалізована в мембрані і відповідальна за зв’язування етилену. Далі в молекулі розташована гістидинова протеїнкіназа, яка повинна фосфорилювати триста п’ятдесят третій гістидин і далі передавати фосфатну групу на 659 -й залишок аспарагінової кислоти, розташованої ближче до Скінця молекули. Судячи з амінокислотної послідовності, в молекулі етиленового рецептора містяться і сенсорна і ефекторна частини бікомпонентних сигнальної системи бактерій.
Генетичні досліди показали, що у арабідопсиса за рецепторним білком ETR1 в системі переносу етиленового сигналу повинен бути розташований білок CTR1, блокуючий в нормі проходження сигналу. Мутація за його гену ctr1 призводить до морфологічних змін у арабідопсису, які могли б виникнути при постійному включенні етиленової програми. Цей білок репресує етиленові програми у дикого типу. Вивчення первинної структури (амінокислотної послідовності) білка CTR1 показало його принадлежність до сімейства широко поширених у еукаріот серин / треонінових протеїнкиназ, які участвують в так званому МАРкіназного каскаді, в якому послідовно одна кіназа фосфорилює іншу і тим самим активує її для фосфорилювання наступній протеїнкінази в ланцюзі передачі сигналу на білки хроматину. 8].
Таким чином встановлено, що в передачі етиленового сигналу в клітинах арабідопсису приймають участь сигнальні системи як бактеріального (гістидинова протеїнкіназа — ETR1 — рецептор етилену), так і еукаріотичного типу (репрессор передачі сигналу CTR1, серин / треонінових протеїнкіназа, що відноситься до МАРкіназного каскаду).
Необхідні дослідження для з’ясування конкуруючої взаємодії в клітинах цих регуляторних систем. Ланцюжок подальших етапів передачі етиленового сигналу ще не вивчена. вона може бути досить складною і включати в себе, наприклад, так звані Gбілки, що показано в лаботорії М. Холла. Ці білки приєднують до себе GTP (гуанозинтрифосфат) і в результаті приднання мають здатність до передачі сигналів від одного білка до іншого. 6].
Відомо, що в кінцевому рахунку етилен включає певні генетичні програми, які забезпечують специфічну відповідь на нього рослиною. Наприклад, індукція етиленом захисних реакцій рослин на патоген включає в себе активацію генів в-1,3- глюканази, лужної хітинази, РR-білків, халконсинтетази і багатих на оксипролін глікопротеїнів. Цього не відбувається у нечуттєвих до етилену мутантів. В даний час не настільки добре вивчені етиленіндукуючі гени та знайдено регуляторні елементи (РЕ) в ДНК їх промоторів, які відповідальні за включення генів етиленом. Ці РЕ мають спільні нуклеотидні послідовності у різних етилен залежних генів. Виявлені білки, здатні впізнавати РЕ етиленіндукуючих генів, що представляють собою, мабуть, трансфактори, взаємодія яких з РЕ включає гени. У цих білках мається загальна амінокислотна послідовність (59 амінокислотних залишків), що забезпечує їх зв’язування з ДНК. Припускають, що ці білки можуть бути мішенню для розглянутого вище сигнального каскаду, хоча це ще необхідно довести, тому на схемі, що підсумовує всі наведені відомості про можливий механізм дії етилену, стрілки, що йдуть до трансфакторам, показані пунктиром (рис. 8).
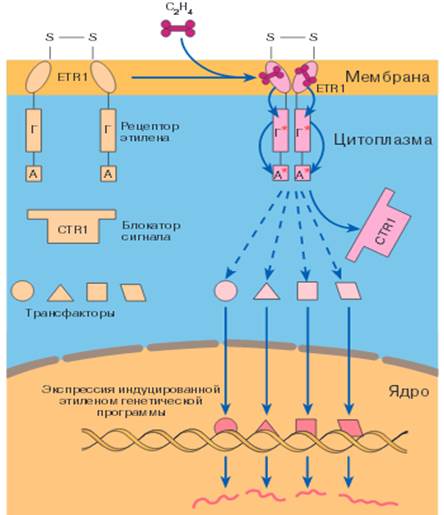
Рис. 8. Гіпотетична схема передачі етиленового сигналу у рослин
В основу представленої схеми покладено одна з гіпотез А. Блікера [12]. дослідження механізму дії етилену розвиваються настільки швидко, що немає сумніву в тому, що найближчим час буде з’ясована вся ланцюг подій від взаємодії етилену з його рецептором до включення етиленіндукуючих генетичних програм.
Досягнутий на Arabidopsis thaliana прогрес у вивченні етиленового рецептора і його гена дозволив виділити відповідний ген з генома томатів і синтезувати в дріжджовий системі закодований в ньому білок з властивостями рецептора етилену (Х. Клей). Цей білок ТАЕ1 організований за тим же принципом, що і ETR1 у арабідопсису. Крім того, у томатів виділені інші гени, гомологічні etr1 арабідопсису, але мають визначені відмінності від нього (Х. Клей). дослідження на арабідопсису і томатах показали, що рецептори етилену кодуються мультигенним сімейством, окремі гени якого по-різному експресуються в ході росту і розвитку рослин.