Морфологічні особливості загоєння дефекту коркового шару довгої кістки щурів за умов імплантації природного гідроксилапатиту

Цель: исследовать процесс заживления дефекта компактной костной ткани после имплантации остеопластического материала Cerabone®. Методы: эксперимент проведен на 24 белых крысах-самцах. В средней трети диафиза бедренной кости с помощью портативной бормашины шаровидной фрезой на малых оборотах и с охлаждением создавали дырчатый дефект диаметром 2,5 мм до костномозгового канала, который… Читати ще >
Морфологічні особливості загоєння дефекту коркового шару довгої кістки щурів за умов імплантації природного гідроксилапатиту (реферат, курсова, диплом, контрольна)
Анотації
The goal: to investigate bone-healing process after implantation of osteoplastic material Cerabone® in compact bone defect. Methods: experiment was performed on 24 white rats (male). Hole-like defect (2.5 mm diameter) was created on the middle third of femur diaphysis using portable drill with spheric mill at low speed with cooling. The defect reached intramedullary canal; it wasfilled with osteoplastic material Cerabone® in experimental animals and was left unfilled in control. Bone fragments were studied on the 15`h and 30lh days using method of light microscopy with morphometry and scanning electron microscopy that was performed on electronic microscope «РЭМ 106-И». Morphometric analysis was carried out using image-processing programs «Видео-тест» and «Видеоразмер». Results: it was found out that material Cerabone® did not provoke any inflammatory reaction. The lacunas with typical osteocytes were located in maternal bone adjacent to the site of transplantation. This fact gives the evidence of material biocompatibility. At all stages of study the signs of desmal osteogenesis only were identified, the presence of bone and connective tissues in defects in both groups pointed on this fact. Bone tissue of regenerate in animals of experimental and control groups on the 15th day took the form of large-loop and small-looped network of trabeculas. On 30th day the areas of bone similar in structure to maternal bone were found. The forming of bone regenerate with high density of osteoblasts and osteocytes was found in the animals of experimental group only on outer side of Cerabone® surface without penetration into osteoplastic material. The entire period of observation Cerabone® provided the stable volume of defect due to good integration with bone tissue of regenerate and absence of reliable signs of resorption. Key words: Cerabone®, hydroxyapatite, reparative osteogenesis, compact bone.
Цель: исследовать процесс заживления дефекта компактной костной ткани после имплантации остеопластического материала Cerabone®. Методы: эксперимент проведен на 24 белых крысах-самцах. В средней трети диафиза бедренной кости с помощью портативной бормашины шаровидной фрезой на малых оборотах и с охлаждением создавали дырчатый дефект диаметром 2,5 мм до костномозгового канала, который в экспериментальной группе животных заполняли остеопластическим материалом Cerabone®, а в контрольной оставляли незаполненным. Фрагменты травмированных костей исследовали на 15 и 30-е сутки методами световой микроскопии с морфометрией и растровой электронной микроскопии, которую выполняли на электронном микроскопе «РЭМ 106-И». Морфометрический анализ осуществляли с использованием программ обработки изображений «ВидеоТест» и «Видео-Размер». Результаты: установлено, что материал Cerabone® не вызывал воспалительной реакции. В прилежащей к месту имплантации материнской кости располагались лакуны с типичными остеоцитами, что свидетельствует о биосовместимости материала. На всех сроках наблюдения выявлены признаки только десмального остеогенеза, на что указывало наличие в дефектах животных обеих групп костной и соединительной ткани. Костная ткань регенерата у животных контрольной и экспериментальной групп на 15-е сутки была представлена крупнои мелкопетлистыми сетчатыми структурами из костных трабекул, а на 30-е сутки обнаружены участки костной ткани, приближающиеся по строению к материнской кости. У животных экспериментальной группы формирование костной ткани регенерата с высокой плотностью остеобластов и остеоцитов происходило только на наружной поверхности Cerabone® без проникновения внутрь остеопластического материала. Весь период наблюдения Cerabone® обеспечивал стабильность объема дефекта благодаря хорошей интеграции с костной тканью регенерата и отсутствием достоверных признаков резорбции. Ключевые слова: Cerabone®, гидроксилапатит, репаративный остеогенез, компактная кость, эксперимент.
Вступ
Однією з важливих проблем, з якою стикаються в своїй практиці лікарі-ортопеди, є регенерація кісткових дефектів. Висока частота причин, які призводять до виникнення дефектів кісток, зумовлює необхідність шукати засоби, які забезпечили б їх повне відновлення [2]. Трансплантація кісткової тканини, що використовують для лікування цієї патології, має багатовікову історію, за роки якої були досягнуті значні успіхи. Однак через високу частоту ускладнень, які виникають під час вказаних операцій, останніми роками відмічено зростання зацікавленості до кальцій-фосфатних остеопластичних матеріалів як альтернативи кістковим трансплантатам [5]. Подібність хімічної будови кальційфосфатних керамік до кісткової тканини і біологічна інертність дають можливість широко використовувати їх для заміщення кісткових дефектів [4].
Остеопластичний препарат з бичачої кістки Cerabone® з’явився на ринку в січні 2002 року. За цей час він продемонстрував високу безпеку щодо алергічних реакцій, бичачої спонгіоформної енцефалопатії та інших інфекцій, оскільки під час виробництва піддається депротеїнізації за допомогою випалу при 1200 °C [11]. Cerabone® та інші препарати на основі бичачого гідроксилапатиту зарекомендували себе як остеопластичні матеріали, що добре інтегрують в новоутворену кісткову тканину [7, 12] і забезпечують відмінну довготривалу стабільність об'єму дефекту внаслідок дуже повільної резорбції [9, 10]. Однак дослідження, на підставі яких отримані викладені факти, проведені на щелепах і губчастих кістках [7, 8, 10], а інформації щодо впливу остеопластичного матеріалу Cerabone® на динаміку загоєння дефекту компактної кісткової тканини в науковій літературі не виявлено. Крім того, у більшості робіт, з вивчення Cerabone®, представлені морфологічні дослідження, в яких бракує морфометричних характеристик гістологічних препаратів і мікроскопічної, особливо електронно-мікроскопічної, характеристики тканинно-специфічних структур регенерату. Тому метою нашої роботи було дослідити процес загоєння дефекту компактної кісткової тканини після імплантації остеопластичного матеріалу Cerabone® за допомогою гістологічного, морфометричного та електронно-мікроскопічного методів.

Рис. 1. Мікроструктура остеопластичного матеріалу Cerabone®. Пори біоматеріалу, одна з яких розміром 250 мкм. Електронна сканограма. Зб. 100.
Матеріал та методи
Експеримент проведений на 24 білих лабораторних щурах-самцях 8-місячного віку масою (250 ± 10) г. Під кетаміновим наркозом (0,3−0,5 мл на 1 кг маси щура) у середній третині діафіза стегнових кісток за допомогою портативної бормашини кулеподібною фрезою на малих обертах із охолодженням відтворювали дефект діаметром 2,5 мм до кістковомозкового каналу. Тварин поділили на дві групи:
I (12 щурів) — контрольна (порівняльна), кістковий дефект залишали загоюватися під кров’яним згустком;
II (12 щурів) — експериментальна, дефект без жорсткої фіксації заповнювали остеопластичним матеріалом Cerabone® (Botiss, Німеччина, реєстраційний номер ФСЗ 2012/12 810). Він є природним гідроксилапатитом губчастої речовини трубчастих кісток корів у формі гранул (2 мм, Ca/P — 1,67), які мають тривимірну пористу структуру (розмір пор 200−350 мкм) шорстку і гідрофільну поверхню (рис. 1) [13]. Крім того, у 1 г Cerabone® міститься близько 1 мг кісткового морфогенетичного протеїну-2, із регуляторною дією якого пов’язують адекватність остеогенезу, диференціювання остеогенних клітин-попередників в остеобласти [11].
Перед імплантацією гранули Cerabone® змочували у власній крові щура, яку брали з хвостової вени, для заповнення пор і видалення залишків повітря з матеріалу, а також для забезпечення більш пластичної консистенції матеріалу. кістковий остеопластичний трансплантат Через 15 і 30 діб після операції тварин виводили з експерименту шляхом декапітації під глибоким ефірним наркозом. Експеримент виконаний відповідно до чинних нормативних документів і схвалено комісією з питань біоетики під час проведення експериментальних та клінічних досліджень медичного інституту Сумського державного університету (протокол № 2/1 від 19.01.2016). Виділені фрагменти травмованих кісток вивчали за допомогою методів світлової (із морфометрією) і растрової електронної мікроскопії, яку виконували на електронному мікроскопі «РЭМ 106-И». Гістологічні зрізи, забарвлені гематоксиліном та еозином, аналізували у світловому мікроскопі «OLYMPUS», фотографували за допомогою цифрової фотокамери. Морфометричний аналіз здійснювали з використанням програм обробки зображень «Видео-Тест» і «Видео-Размер» [3]: визначали в ділянці дефекту відносний відсоток кісткової та сполучної тканини, а також залишків остеопластичного матеріалу як відношення площ зазначених компонентів (%) до загальної площі ділянки дефекту (100%). Крім того, досліджували структуру прилеглої до місця імплантації материнської кістки з метою встановлення або спростування післяопераційних ускладнень через наявність або відсутність в її складі ознак некробіозу і некрозу остеоцитів [1]. Отримані числові показники опрацьовували статистично з обчисленням середнього арифметичного (М) і його стандартної похибки (m). Значущість відмінностей між порівнюваними показниками оцінювали за допомогою t-критерію Стьюдента з використанням статистичної комп’ютерної програми MS Excel XP. Відмінності вважали значущими за р < 0,05 [6].
Результати та їх обговорення
15-а доба експерименту
У тварин контрольної групи в ділянці дефекту виявлений регенерат, який містив (47,66 ± 2,3) % грубоволокнистої кісткової та (52,34 ± 2,3) % сполучної тканини. Кісткова тканина була представлена трабекулами, які утворювали дрібноі великопетлясті сітчасті структури з численними остеобластами та остеоцитами. Міжтрабекулярний простір заповнювала сполучна тканина, яка містила фібробласти, колагенові волокна і судини. Материнська кістка характеризувалася наявністю поодиноких порожніх остеоцитарних лакун, які перемежовувалися зі збереженими клітинами (рис. 2).
У тварин ІІ групи в кістковому дефекті виявлялися гранули імплантованого остеопластичного матеріалу Cerabone®, які після забарвлення гематоксиліном та еозином набували темно-зеленого кольору і займали (43,93 ± 2,28) % від усієї площі дефекту. Висока щільність Cerabone® зумовлювала викришування часток імплантату під час зрізування зразка для гістологічного дослідження. Завдяки цьому на місці остеопластичного матеріалу інколи спостерігали порожнини. Між окремими фрагментами Cerabone® і безпосередньо на їх поверхні утворювалися кісткова і сполучна тканини регенерату. Усередині залишків остеопластичного матеріалу остеогенних клітин або вогнищ остеоі фіброгенезу не виявляли. Кісткова і сполучна тканини займали (34,00 ± 1,45) % і (22,07 ± 1,14) % відповідно всієї площі дефекту, що було на 40,17% (р < 0,05) і 137,15% (р < 0,05) менше, ніж у тварин контрольної групи.
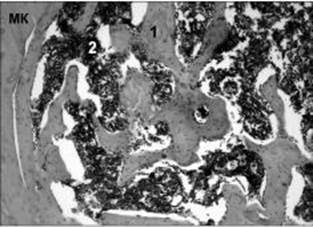
Рис. 2. Мікрофото. Ділянка дефекту стегнової кістки щура контрольної групи на 15-у добу після нанесення дефекту. Новоутворена грубоволокниста кісткова тканина (1) на межі з материнською кісткою (МК). Кістковий мозок (2) у міжтрабекулярному просторі. Гематоксилін та еозин. Зб. 100.

Рис. 3. Ділянка дефекту стегнової кістки щура на 15-у добу після імплантації Cerabone®. Остеобласт (1) на поверхні кісткової трабекули регенерату, яка утворилася безпосередньо на остеопластичному матеріалі. Електронна сканограма. Зб. 6000.
У порожнині дефекту відмічали ділянки, де між кістковою тканиною і остеопластичним матеріалом розташовувалася сполучна тканина, а також місця безпосереднього контакту Cerabone® з кістковою тканиною регенерату. Вона була представлена кістковими трабекулами, які утворювали великоі дрібнопетлясті сітчасті структури. У міжтрабекулярних просторах розташовувалися залишки остеопластичного матеріалу і сполучна тканина регенерату. У складі кісткової тканини регенерату виявили первинні остеобласти, остеоцити, остеогенні клітини (рис. 3), а у прилеглій до ділянки імплантації материнській кістці спостерігали остеоцитарні лакуни з типовими остеоцитами.
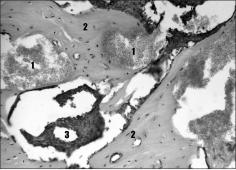
Рис. 4. Мікрофото. Ділянка дефекту стегнової кістки щура на 30-у добу після імплантації Ceiabone®. Остеопластичний матеріал (1) інтегрований у кісткову тканину регенерату (2), між окремими частинами якої розташовується сполучна тканина (3). Зб. 200.

Рис. 5. Ділянка дефекту стегнової кістки щура на 30-у добу після імплантації Cerabone®. Остеогенна клітинна (1), первинний остеобласт (2) і остеоцит (3) у лакунах грубоволокнистої кісткової тканини, яка утворилася на поверхні остеопластичного матеріалу. Електронна сканограма. Зб. 2000.
30-а доба експерименту
У ділянці дефекту кісток тварин контрольної групи визначали пластинчасту і грубоволокнисту кісткову тканину загальною площею (75,9 ± 2,72) %, що на 59,33% (р < 0,05) більше, ніж на 15-у добу експерименту. Решту площі дефекту заповнював кістковий мозок. Пластинчаста кісткова тканина за будовою наближалася до материнської, у ній виявлені остеобласти, остеоцити і сформовані остеони. Однак переважно в дефекті відмічені великі трабекули грубоволокнистої кісткової тканини з кістковим мозком у міжтрабекулярних просторах.
У ділянці дефекту тварин експериментальної групи спостерігали новоутворену кісткову тканину, яка мала не тільки грубоволокнисту, але й пластинчасту будову. Кісткова тканина розділяла фрагменти Cerabone® на окремі частинки і запаювала їх у свої структури (рис. 4). При цьому в центральних ділянках остеопластичного матеріалу, як і на 15-у добу експерименту, не виявлено остеогенних клітин або вогнищ остеоі фіброгенезу. У лакунах і на поверхні кісткової тканини регенерату містилися остеогенні клітини, первинні, вторинні остеобласти, остеоцити, інколи остеокласти (рис. 5). У прилеглій до місця імплантації материнській кістці виявляли типові остеоцити з довгими відростками.
Площа кісткової тканини регенерату порівняно з попереднім терміном спостереження збільшилася на 15,47% і становила (39,26 ± 1,32) % (р < 0,05), але це було на 48,27% (р 0,05) порівняно з 15-ю добою і становила (42,61 ± 1,55) %. Окрім кісткової тканини, гранули імплантату оточувала сполучна тканина, морфологічна структура якої була представлена колагеновими волокнами, фібробластами і кровоносними судинами, а її площа порівняно з попереднім терміном спостереження зменшилася на 17,85% (р < 0,05) і становила (18,13 ± 0,99) %.
Висновки
Остеопластичний матеріал Cerabone® має високу біосумісність, про що свідчить відсутність запальної реакції в порожнині дефекту, а також наявність у прилеглій до ділянці імплантації остеопластичного матеріалу материнській кістці типових остеоцитів без ознак їх некробіозу і некрозу.
У тварин досліджуваних груп виявлені ознаки тільки десмального остеогенезу, на що вказує наявність у ділянці дефекту сполучної і кісткової тканин регенерату.
Кісткова тканина регенерату у тварин контрольної та експериментальної групи на 15-у добу представлена великоі дрібнопетлястими сітчастими структурами з кісткових трабекул, а на 30-у добу виявлено ділянки кісткової тканини, які наближаються за будовою до материнської кістки.
У тварин експериментальної групи формування кісткової тканини регенерату з високим вмістом остеогенних клітин, остеобластів і остеоцитів відбувалося тільки на зовнішній поверхні залишків Cerabone® без її проникнення всередину остеопластичного матеріалу.
Препарат Cerabone® забезпечує стабільність об'єму дефекту завдяки хорошої інтеграції з кістковою тканиною регенерату і відсутністю достовірних ознак резорбції остеопластичного матеріалу протягом усього терміну експерименту.
Конфлікт інтересів. Автор декларує відсутність конфлікту інтересів.
Список літератури
- 1. Григорьян А. С. Проблемы интеграции имплантатов в костную ткань (теоретические аспекты) / А. С. Григорьян, А. К. Топоркова. — М.: Техносфера, 2007. — 128 с.
- 2. МакКиннис Линн Н. Лучевая диагно стика в травматологии и ортопедии. Клиническое руководство / Линн Н. МакКиннис; пер. с англ. Н. А. Шестерни. — М.: Издательство Панфилова, 2015. — 644 с.
- 3. Осипенкова-Вичтомова Т К. Гистоморфологическая экспертиза костей / Т К. Осипенкова-Вичтомова. — М.: ОАО «Издательство «Медицина», 2009. — 152 с.
- 4. Панкратов А. С. Костная пластика в стоматологии и челюстно-лицевой хирургии. Остеопластические материалы: Руководство для врачей / А. С. Панкратов, М. В. Лекишвили, И. С. Копецкий. — Москва: БИНОМ, 2011. — 272 с.
- 5. Севастьянов В. И. Биосовместимые материалы / В. И. Севастьянов, М. П. Кирпичников. — М.: ООО «Издательство «Медицинское информационное агентство», 2011. — 544 с.
- 6. Халафян А. А. STATISTICA 6. Математическая статистика с элементами теории вероятностей / А. А. Халафян. — М.: Издательство Бином, 2011. — 496 с.
- 7. Effect of guided tissue regeneration on newly formed bone and cementum in periapical tissue healing after endodontic surgery: DOI: http://dx.doi.org/10.15 674/0030−59 872 016 184−88 an in vivo study in the cat / Z. Artzi, N. Wasersprung, M. Weinreb [et. al.] // J. Endodontics. — 2012. — Vol. 38 (2). — P. 163−169, doi: 10.1016/jjoen.2011.10.002.
- 8. Evaluation of a novel nanocrystalline hydroxyapatite paste and a solid hydroxyapatite ceramic for the treatment of critical size bone defects (CSD) in rabbits / F.-X. Huber, I. Berger, N. McArthur [et. al.] // J. Mater. Sci. Mater. Med. — 2008. — Vol. 19 (1). — P. 33−38.
- 9. Histological and histomorphometrical analyses of biopsies harvested 11 years after maxillary sinus floor augmentation with deproteinized bovine and autogenous bone / А. Mordenfeld, M. Hallman, C. B. Johansson [et. al.] // Clinical Oral Implants Research. — 2010. — Vol. 21 (9). — P. 961−970, doi: 10.1111/j.1600−0501.2010.1 939.x.
- 10. Influence of material properties on rate of resorption of two bone graft materials after sinus lift using radiographic assessment / F. Riachi, N. Naaman, C. Tabarani [et. al.] // Int. J. of Dent. — 2012. — Vol. 2012. — P. 1−7, doi: 10.1155/2012/737 262.
- 11. Seidel P. Cerabone® — eine Spongiosa-Keramik bovinen Ursprungs / P. Seidel, E. Dingeldein // Materialwissenschaft und Werkstofftechnik. — 2004. — Vol. 35 (4). — P. 208−212.
- 12. Sinus floor elevation using a sintered, natural bone mineral — A histological case report study / D. Rothamel, R. Smeets, A. Happe [et. al.] // Int. J. Oral. Maxillofac. Implants. — 2012. — Vol. 27 (1). — P. 146−154.
- 13. Tadic D. A thorough physicochemical characterisation of 14 calcium phosphate-based bone substitution materials in comparison to natural bone / D. Tadic, M. Epple // Biomaterials. — 2004. — Vol. 25. — P. 987−994.