Механізми біологічної активності низькоінтенсивного радіочастотного випромінювання

Найбільш уживаними індексами оксидативного стресу в цих дослідженнях були рівні продукції АФК, пероксидів ліпідів (ПОЛ), малонового діальдегіду (МДА), окисне ушкодження протеїнів, оксиди азоту (NO^), рівень глутатіону (GSH) та активність ензимівантиоксидантів. В окремих дослідженнях виявлено гіперпродукцію радикальних форм кисню та оксиду азоту як першу реакцію на опромінення. Як зазначалося… Читати ще >
Механізми біологічної активності низькоінтенсивного радіочастотного випромінювання (реферат, курсова, диплом, контрольна)
Анотація
Механізми біологічної активності низькоінтенсивного радіочастотного випромінювання
Чехун Василь Федорович — академік НАН України, доктор медичних наук, професор, директор Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України Якименко Ігор Леонідович, доктор біологічних наук, професор кафедри біохімії та екологічного контролю Національного університету харчових технологій Этот адрес e-mail защищен от спам-ботов. Чтобы увидеть его, у Вас должен быть включен Java-Script.
Цибулін Олександр Сергійович, кандидат біологічних наук, доцент кафедри вищої математики і фізики Білоцерківського національного аграрного університету Сидорик Євгеній Петрович, доктор медичних наук, професор, завідувач лабораторії біофізики Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України Кириленко Сергій Дмитрович, кандидат біологічних наук, професор факультету структурної та функціональної біології Університету Кампінаса, Бразилія УДК 537.8 МЕХАНІЗМИ Огляд присвячено аналізу експериментальних даних щодо біологічних ефектів низькоінтенсивного радіочастотного випромінювання. Наявні на сьогодні результати досліджень свідчать про те, що радіочастотне випромінювання нетеплових інтенсивностей, взаємодіючи з іонами і локальними зарядами макромолекул, може потенційно впливати на рівень метаболізму клітини, активізувати вільнорадикальні та пероксидні процеси, пригнічувати активність ензимів антиоксидантного захисту, призводити до окисного ушкодження ДНК. Наведені дані дають змогу класифікувати низькоінтенсивне радіочастотне випромінювання як стресовий/оксидативний чинник для клітини.
Ключові слова: вільні радикали, оксидативний стрес, радіочастотне випромінювання, активні форми кисню, ушкодження ДНК, апоптоз.
Аннотация
Механизмы биологической активности низкоинтенсивного pадиочастотного излучения
Обзор посвящен анализу экспериментальных данных о биологических эффектах низкоинтенсивного радиочастотного излучения. Существующие на сегодня результаты экспериментальных исследований указывают на то, что радиочастотное излучение нетепловых интенсивностей способно взаимодействовать с ионами и локальными зарядами молекул, потенциально оказывая влияние на уровень метаболизма клетки, может активизировать свободнорадикальные и перекисные процессы, подавлять активность энзимов антиоксидантной защиты, приводить к окислительному повреждению ДНК. Приведенные данные позволяют классифицировать низкоинтенсивное радиочастотное излучение как стрессовый / оксидативный фактор для клетки.
Ключевые слова: свободные радикалы, оксидативный стресс, радиочастотное излучение, активные формы кислорода, повреждения ДНК, апоптоз.
Annotation
біологічний ефект радіочастотний випромінювання.
Mechanisms of biological activity of low-intensity radiofrequency radiation
V.F. Chekhun, LL. Yakymenko, O.S. Tsybulin, E.P. Sidorik, S.D. Kyrylenko.
This review aims to analyze experimental data on biological effects of radiofrequency radiation. Recent experimental data indicate that the low-intensity radiofrequency radiation is able to interact with ions and local charges of molecules, potentially affects cell metabolism, leads to activation of free radical processes, accompanied by activation of peroxide processes, changes activity of antioxidant defense enzymes, and causes oxidative damage to DNA. These data allow to classify low-intensity radiofrequency radiation as an oxidative stress-factor for living cell.
Keywords: free radicals, oxidative stress, radiofrequency radiation, reactive oxygen species, DNA damage, apoptosis.
Вступ
Інтенсивний розвиток бездротових технологій протягом останніх десятиліть зумовив різке зростання фону радіочастотного випромінювання (РЧВ) у навколишньому середовищі. Рівень цього фактора у житлових приміщеннях індустріально розвинених країн з 1985 по 2005 р. зріс у 5000 разів [1]. Суттєве збільшення електромагнітного опромінення викликає закономірне занепокоєння щодо ризиків для здоров’я людини. Доказом такого впливу є серія епідеміологічних досліджень, у яких показано зростання ризику виникнення онкологічних захворювань у активних користувачів мобільних телефонів [2—5]. Результати інших досліджень вказують на те, що тривалий вплив РЧВ спричинює також і неонкологічні розлади в організмі людини, наприклад головний біль, втому, депресію, шум у вухах, подразнення шкіри, гормональні порушення тощо [6—8]. Крім того, опубліковано переконливі дані щодо негативної дії РЧВ на зародкові клітини людини [9]. Слід зазначити, що в усіх наведених дослідженнях біологічні ефекти було виявлено за інтенсивності РЧВ, нижчої за норми безпеки, затверджені Міжнародною комісією із захисту від неіонізуючого випромінювання (ICNIRP) [10]. Незважаючи на те, що останнім часом було опубліковано кілька робіт [11 — 14] з вивчення метаболічних змін у живих клітинах за дії РЧВ, молекулярні механізми нетеплових ефектів РЧВ є «вузьким місцем» у розумінні впливу низькоінтенсивного РЧВ на здоров’я людини. Цей огляд присвячений аналізу молекулярних ефектів РЧВ низької інтенсивності у живих клітинах та модельних системах з особливим акцентом на оксидативні ефекти і вільнорадикальні процеси. Парадоксально, але РЧВ може призводити до значної активації вільнорадикальних процесів та гіперпродукції активних форм кисню (АФК) у живих клітинах. На нашу думку, аналіз останніх досліджень дозволить побачити загальну картину потенційного впливу РЧВ на здоров’я людини.
Радіочастотне випромінювання
РЧВ є електромагнітним випромінюванням з частотою від 30 кГц до 300 ГГц і класифікується як неіонізуюче, оскільки не має достатньої енергії для іонізації атомів і молекул. РЧВ з найвищою частотою (від 300 МГц до 300 ГГц) належить до мікрохвильового діапазону і потенційно може зумовлювати теплові ефекти при взаємодії з речовиною. Основними характеристиками РЧВ є його частота, інтенсивність, або питома потужність випромінювання, та його природа — модульоване чи немодульоване, постійне чи імпульсне випромінювання. Для визначення кількості поглинутої тканинами електромагнітної енергії використовують величину SAR (Specific Absorption Rate). На сьогодні найпоширеніший у світі цифровий стандарт GSM використовує електромагнітні хвилі з частотою 850; 900; 1800 та 1900 МГц. Випромінювання є частотно модульованим з частотою зміни каналів 217 Гц [15].
Міжнародні норми безпеки встановлюють верхню межу РЧВ на рівні 450—1000 мкВт/см2 (залежно від частоти випромінювання), а рівень SAR не повинен перевищувати 2 Вт/кг при локальному опроміненні голови або тулуба людини [10]. Ці норми були прийняті ICNIRP на основі експериментальних досліджень на лабораторних щурах з визначення інтенсивності мікрохвильового випромінювання (МХВ), за якої тварини фізично відчували теплову дію випромінювання і намагалися залишити зону опромінення або припиняли вживати їжу [16].
Низькоінтенсивним РЧВ називають випромінювання з інтенсивністю, яка не викликає значного теплового ефекту в біологічних тканинах, тобто відповідає нормам ICNIRP В огляді ми розглядатимемо вплив тільки низькоінтенсивного РЧВ.
Фізичні/біофізичні ефекти низькоінтенсивного РЧВ у живих клітинах
РЧВ, і особливо МХВ, може викликати теплові ефекти в речовині внаслідок взаємодії із зарядженими частинками, зокрема вільними електронами, іонами або полярними молекулами, що спричинює їх коливальний рух в електромагнітному полі. Тепловий ефект МХВ ми спостерігаємо щоразу, підігріваючи їжу в мікрохвильовій печі. Ефект залежить від інтенсивності випромінювання і є незначним, коли йдеться про низькоінтенсивне МХВ. Енергії РЧВ/МХВ недостатньо не тільки для іонізації молекул, а й для змінення енергії орбітальних електронів. Саме тому РЧВ часто сприймають як фактор, що зумовлює виключно тепловий ефект. Однак виявлені біологічні ефекти низькоінтенсивного РЧВ спонукали до проведення досліджень з вивчення фізичних механізмів нетеплових ефектів цього виду випромінювання.
Було запропоновано біофізичну модель [17], у якій наголошено на значущості «силових вібрацій», що діють з боку електромагнітного поля на вільні іони на поверхні клітинної мембрани. Це може призвести до порушення електрохімічного балансу клітини.
Модель «взаємодії рухомих зарядів», запропонована М. Бланком [18], ґрунтується на взаємодії магнітного поля з електричними зарядами, які рухаються в молекулі ДНК, що призводить до активації синтезу білків теплового шоку під дією низькочастотного електромагнітного випромінювання. Також було продемонстровано [18, 19], що електромагнітне випромінювання підвищує швидкість переносу електронів у цитохромоксидазі і змінює активність Na/K-АТФази. Крім того, встановлено [20] прискорення автоколивальних процесів окисно-відновних реакцій (реакція Білоусова—Жаботинського) у гомогенних розчинах під дією низькочастотного електромагнітного поля.
Показано [21], що низькоінтенсивне імпульсне магнітне поле здатне спричиняти «вмикання» та «вимикання» потенціалу дії певних типів нейронів. Короткочасність магнітного стимулу (0,2 мс) навела авторів на думку про пряму взаємодію між полем та іонними каналами у плазматичній мембрані.
Ще один фізичний механізм біологічно значущих змін у живих клітинах під дією низькоінтенсивного МХВ було запропоновано на основі можливої переорієнтації спіну електрона у «зв'язаних» парах вільних радикалів у магнітному полі електромагнітної хвилі [22].
Виявлено виражений нетепловий ефект МХВ на структурно-функціональні властивості феритину — залізовмісного білка, який є в більшості живих організмів, від бактерій до людини [23]. Під дією магнітного поля мікрохвиль нетеплових інтенсивностей вивільнення іонів заліза з феритину зменшувалося більш ніж утричі. Автори зазначають, що магнітне поле РЧВ відіграє ключову роль у виявленому ефекті, який є виключно нетепловим. Механізм взаємодії магнітного поля радіохвиль з феритином, імовірно, пов’язаний з іонами заліза, що входять до його складу у формі парамагнітних наночастинок. У результаті скорочується введення хелатів заліза у структуру феритину. Автори підкреслюють потенційну роль дисфункції феритину в оксидативних процесах у живій клітині завдяки участі іонів Fe2+ у реакції Фентона, продуктом якої є гідроксильний радикал. У цьому аспекті важливо відзначити результати дослідження з опромінення лімфоцитів щурів у середовищі, що містило іони заліза [24]. За відсутності іонів заліза мікрохвилі частотою 930 МГц не спричинювали гіперпродукцію внутрішньоклітинних АФК, тоді як за наявності у середовищі FeCl2 спостерігалася достовірна гіперпродукція АФК.
Інші роботи демонструють можливі конформаційні зміни білкових молекул під дією РЧВ. Так, низькоінтенсивне РЧВ частотою 2,45 ГГц зумовлює конформаційні зміни р-лактоглобуліну через збудження так званих внутрішніх мод [25], що свідчить про принципову можливість РЧВ модулювати невипадкові синхронні рухи цілих ділянок білка. Також спостерігався частотозалежний ефект змінного електричного поля на внутрішню структуру молекули інсуліну [26]. Крім того, модульоване РЧВ стандарту GSM спричинювало значні зміни макромолекулярної структури цитоскелета фібробластів китайського хом’ячка [27]. Так, 3-годинне опромінення фібробластів призвело до зміни структури мікротрубочок та актинових мікрофіламентів, які є полярними структурами цитоскелета, тоді як неполярні віментинові структури залишилися без змін. Враховуючи широкі регуляторні можливості білків цитоскелета, ці дані, очевидно, можуть мати істотне значення для розуміння природи біологічних ефектів радіовипромінювання.
Показано, що активність орнітиндекарбоксилази зазнає суттєвих змін при дії низькоінтенсивного РЧВ [28].
Крім того, продемонстровано так звані «кальцієві ефекти» в живих клітинах за дії РЧВ [29], що проявлялися у значному зростанні рівнів внутрішньоклітинного Са2+. З огляду на те, що кальцій є поширеним регулятором метаболізму клітини, ці дані вказують на те, що нетеплові ефекти радіовипромінювання можуть активувати сигнальні каскади, регулятором яких є саме іони Са2+.
І нарешті, було продемонстровано [30] можливість дисоціації незначної кількості молекул води під дією низькоінтенсивного МХВ. Показано, що МХВ частотою 10 ГГц та інтенсивністю 30 мВт продукує значний рівень Н2О2 у деіонізованій воді (а також у розчині MgSO4) за сталої температури. На думку авторів, кінетичне збудження води після поглинання МХВ спричинює втрату в’язкості через тертя між кластерами молекул води С (Н2О2), що рухаються. Внаслідок механохімічної реакції відбувається часткове незворотне розкладання води, зокрема розриви внутрішньомолекулярних зв’язків (Н—ОН) та генерування Н, ОН, Н та ОН—груп. Гідроксильний радикал (ОН), як найагресивніша форма АФК, може розірвати будь-який хімічний зв’язок оточуючих молекул [31]. Враховуючи потужний окисний потенціал гідроксилу, навіть незначні кількості ОН можуть істотно впливати на формування оксидативного стресу в клітині. Наприклад, один ОН-радикал спричинює утворення сотень молекул пероксидів ліпідів у клітині [32].
Отже, на сьогодні виявлено свідчення взаємодії нетеплових інтенсивностей РЧВ із зарядженими частинками, молекулами і клітинними структурами, що може мати важливі наслідки для клітинного метаболізму.
Генерування активних форм кисню в живих клітинах під дією РЧВ
Для життєдіяльності всіх аеробних організмів потрібен молекулярний кисень. Проте порушення у використанні кисню клітиною в процесі нормального метаболізму призводить до утворення АФК [31]. Так, супероксидний аніон-радикал (О2-^) генерується НАДНоксидазою при порушенні транспорту електронів у мітохондріях, при печінковому метаболізмі деяких молекул, а також у результаті розкладання оксигемоглобіну [32].
Пероксид водню (H2O2) утворюється в реакції дисмутації супероксидного радикала. Пероксид водню не є вільним радикалом, але за наявності перехідних металів у реакції Фентона він швидко перетворюється на гідроксильний радикал [33], який вступає в хімічні реакції практично з будь-якою молекулою в живій клітині (ліпіди, цукри, амінокислоти, нуклеотиди тощо) з дуже високими константами швидкості [34], внаслідок чого відбуваються порушення метаболізму аж до нейродегенеративних змін, аутоімунних процесів та онкотрансформації клітин [35—37].
Організм має кілька захисних механізмів, які видаляють АФК з внутрішньоклітинного середовища. Першою лінією захисту клітини є антиоксидантні ензими, які перетворюють ці токсичні агенти на нешкідливі побічні продукти. Наприклад, супероксиддисмутаза (СОД) перетворює О2-^ на H2O2. Два ензими — пероксидаза і каталаза — беруть участь у видаленні H2O2 з внутрішньоклітинного середовища. Найпоширенішою пероксидазою є глутатіонпероксидаза (GSH-Px), що міститься як у цитозолі, так і в мітохондріях. Цей фермент в активному центрі має перехідний метал селен і використовує відновлений глутатіон (GSH) як субстрат для передачі електронів H2O2 (та інших пероксидів), перетворюючи його на дві молекули води. Другим ензимом, який захищає клітину від надлишку H2O2, є каталаза (KAT), що міститься переважно у пероксисомах і має у своїй структурі іони Fe3+. Каталаза перетворює молекули Н2О2 на молекулярний кисень і воду [38]. Коли рівновага між вільними радикалами (оксидантами) та системою антиоксидантного захисту зміщується в бік оксидантів, виникає оксидативний стрес, який може мати негативні наслідки для метаболізму клітини.
Отже, поява в клітині підвищених рівнів АФК, як і пригнічення активності ензимів антиоксидантного захисту під дією того чи іншого фактора, є ознакою оксидативного стресу і свідченням згубного, негативного впливу цього фактора на клітину. З розвитком оксидативного стресу в клітинах пов’язують цілу низку серйозних патологій, у тому числі процеси канцерогенезу, старіння тощо. Тому не дивно, що вільнорадикальні процеси за участі АФК стали предметом досліджень щодо біологічних ефектів випромінювання систем мобільного зв’язку.
На роль акцептора РЧВ у живих клітинах було запропоновано НАДН-оксидазу клітинної мембрани [39]. Використовуючи очищені мембрани культури клітин HeLa, автори роботи [39] експериментально довели, що внаслідок дії РЧВ 875 МГц (200 мкВт/см2) протягом 5 або 10 хв активність НАДН-оксидази достовірно зростала майже втричі. НАДН-оксидази — це мембранозв’язані ензими, що каталізують одноелектронне відновлення кисню в супероксидні радикали, використовуючи НАДН як донора електрона і генеруючи потужні АФК. Цей ензим став відомим завдяки виявленню його ролі в індукції окисного вибуху у фагоцитах як частини імунної відповіді. Пізніше існування нефагоцитарної НАД (Ф)Ноксидази було встановлено у різних типах клітин, зокрема у фібробластах, ендотеліоцитах, міокардіоцитах тощо [40]. Очевидно, що наявність ензиму, який генерує супероксид у багатьох типах нефагоцитарних клітин, вказує на вагому регуляторну роль АФК у живих клітинах. З іншого боку, здатність низькоінтенсивного РЧВ модулювати активність НАДН-оксидази автоматично робить цей фактор небезпечним для клітинного метаболізму. Автори дослідження також показали, що продукція О2- була зумовлена активністю НАДНоксидази, а не НАДФН-оксидази, яка також міститься у плазматичній мембрані [41].
Іншим потужним джерелом АФК у клітинах є мітохондріальний електрон-транспортний ланцюг (ЕТЛ) мітохондрій, який може генерувати супероксид унаслідок порушення транспорту електронів [42]. На сперматозоїдах людини було показано, що генерування АФК мітохондріями може бути активоване дією на них РЧВ частотою 1,8 ГГц [43]. Значне зростання рівня АФК у сперматозоїдах було виявлено при дії РЧВ з SAR=1 Вт/кг, що є нижчим за офіційні санітарні норми, прийняті у багатьох країнах. У нашій лабораторії було показано, що опромінення перепелиних ембріонів in ovo наднизькою інтенсивністю РЧВ протягом перших діб ембріогенезу призводить до значної гіперпродукції супероксидного радикала та оксиду азоту в мітохондріях ембріональних клітин [44]. Невідомо, яка саме ділянка ЕТЛ відповідає за взаємодію з РЧВ, але було показано три можливих місця генерації супероксиду в ЕТЛ: комплекс І [42], комплекс ІІ [45] та комплекс ІІІ [46]. Встановлено обернену кореляцію між мембранним потенціалом мітохондрій та рівнем АФК у живій клітині [47]. Як зазначають автори роботи, такий зв’язок зумовлений двома пов’язаними між собою явищами: АФК призводять до пошкодження мембрани мітохондрій, а пошкоджені мембрани мітохондрій збільшують продукцію АФК.
Крім ключової ролі мітохондрій в енергетичному метаболізмі, ці органели виконують ще одну важливу функцію — регуляцію апоптозу. Це пов’язано з тим, що мітохондрії є потужним внутрішньоклітинним джерелом АФК. Мітохондріально генеровані АФК відіграють важливу роль у звільненні цитохрому С та інших проапоптичних білків, які можуть викликати активацію каспаз і апоптоз [48]. Експериментальні дані вказують на активацію апоптозу за дії низькоінтенсивного РЧВ. На культурі лінії КВ-клітин епідермоїдного раку людини було встановлено, що РЧВ частотою 1950 МГц викликає часозалежний апоптоз (45% після 3 год опромінення), що супроводжується зниженням у 2,5 раза експресії генів Ras і Raf-1 та активності Ras і Erk-½ [49]. Активацію каспаз-2, каспаз-6 та Asc (цитозольний адаптерний протеїн) продемонстровано на первинно культивованих нейронах та астроцитах унаслідок дії РЧВ GSM 1900 МГц протягом 2 годин [50]. Активація в нейронах відбувалася в режимах «розмова» та «очікування», а в астроцитах — тільки у режимі «розмова». Слід підкреслити, що в цьому дослідженні було продемонстровано надзвичайно високу біологічну чутливість до РЧВ, враховуючи, що інтенсивність випромінювання мобільних телефонів у режимі «очікування» мізерно мала (до сотих мкВт/см2).
Ми проаналізували всі доступні експериментальні роботи, опубліковані в рецензованих журналах, щодо розвитку оксидативного стресу в живих клітинах/організмах під дією низькоінтенсивного РЧВ [51]. Усього було виявлено 100 відповідних публікацій. При цьому у 93 роботах показано достовірні ефекти розвитку оксидативного стресу в біологічних об'єктах унаслідок дії мікрохвильового випромінювання, у 7 роботах таких ефектів не виявлено. Серед цих робіт — 18 досліджень in vitro, 73 виконано на тваринних організмах, 3 — на рослинах, у 6 дослідженнях аналізували стан людей, що зазнавали дії мікрохвиль. Більшість досліджень було проведено на лабораторних щурах (58 робіт, у 54 з яких виявили позитивний результат), водночас 4 дослідження з 6, проведених на людині, також дали позитивний результат. З усіх експериментів in vitro 17 (94,4%) були позитивними, в тому числі 2 експерименти на сперматозоїдах людини і 2 — на клітинах крові.
У більшості аналізованих досліджень як джерела РЧВ використовували тестові або комерційні моделі мобільних телефонів, тобто рівні опромінення були відповідні тим, які реально отримують користувачі засобів мобільного зв’язку. Інтенсивність випромінювання в цих дослідженнях варіювала від 0,1 до 680 мкВт/см2, величина поглинутої енергії (SAR) — від 3 до рекомендованих ICNIRP 2 Вт/кг, час опромінення — від 5 хв до 12,5 років, 29,6 год/місяць [51].
Найбільш уживаними індексами оксидативного стресу в цих дослідженнях були рівні продукції АФК, пероксидів ліпідів (ПОЛ), малонового діальдегіду (МДА), окисне ушкодження протеїнів, оксиди азоту (NO^), рівень глутатіону (GSH) та активність ензимівантиоксидантів. В окремих дослідженнях виявлено гіперпродукцію радикальних форм кисню та оксиду азоту як першу реакцію на опромінення [39, 44]. Як зазначалося раніше, експериментально було доведено пряму активацію НАДН-оксидази [39] та мітохондріальний шлях гіперпродукції супероксиду [43, 44]. Крім того, в деяких дослідженнях вказується на гіперпродукцію оксиду азоту після дії РЧВ [44, 52, 53]; проте залишається незрозумілим, чи причиною цього є індукція NO-синтази, чи пряма активація ензиму. Однак очевидно, що достовірне зростання рівнів цих вільних радикалів (супероксиду та оксиду азоту) в клітинах унаслідок опромінення РЧВ призводить до активації пероксидного окиснення та зниження активності ключових ензимів антиоксидантної системи. У ряді модельних досліджень продемонстровано ефективність класичних антиоксидантів для зменшення оксидативного стресу в організмі тварин за дії мікрохвильового опромінення. Такі ефекти було виявлено для мелатоніну [54], вітамінів E і C [55, 56], фенетилефіру кавової кислоти [54], селену, L-карнітину [57] та екстракту часнику [52, 53].
Варто підкреслити, що в цитованих дослідженнях гіперпродукція АФК відбувалася виключно за нетеплових інтенсивностей РЧВ. Було продемонстровано [44, 58], що для стимуляції значного оксидативного стресу в живих клітинах достатньо інтенсивності РЧВ 0,1 мкВт/см2 та SAR 0,3 мкВт/кг. Ці дані особливо важливі з огляду на те, що сучасні норми «безпечних» рівнів РЧВ ґрунтуються виключно на теплових ефектах випромінювання і перебувають у межах від 450 до 1000 мкВт/см2, SAR 2 мкВт/кг [59]. Крім того, при вивченні дії високих (теплових) інтенсивностей РЧВ на біологічні об'єкти не було виявлено оксидативних ефектів [60—62], що може вказувати на відмінність молекулярних механізмів біологічної дії РЧВ за різних інтенсивностей випромінювання.
Отже, проведений аналіз виявив переконливі експериментальні докази розвитку оксидативного стресу в біологічних об'єктах під дією низькоінтенсивного РЧВ.
Оксидативне ушкодження ДНК за дії РЧВ
На сьогодні опубліковано понад 100 робіт, присвячених мутагенній дії РЧВ, у більшості з яких ідеться про значні ефекти [63]. У багатьох дослідженнях показано формування мікроядер [64—66] або структурні аномалії метафазних хромосом [67—69] у клітинах під дією низькоінтенсивного РЧВ. Деякі автори успішно використовували метод ДНК-комет [70—75]. У частині досліджень визначали специфічний маркер оксидативного ушкодження ДНК 8-гідрокси-2'-дезоксигуанозин (8-OHdG) [43, 44, 76—78]. Так, рівень 8-OH-dG у сперматозоїдах людини достовірно зростав після in vitro опромінення низькоінтенсивним РЧВ [43]. Ми показали, що опромінення перепелиних ембріонів in ovo РЧВ (GSM 900 МГц, 0,25 мкВт/см) протягом кількох діб достатньо для достовірного зростання у 2—3 рази рівня 8-OH-dG в ембріональних клітинах [44].
Логічно було б припустити, що більшість виявлених мутагенних ефектів при дії РЧВ зумовлені оксидативним ушкодженням ДНК внаслідок гіперпродукції АФК у живих клітинах за низькоінтенсивного РЧВ. Відомо, що сам по собі супероксид не впливає на ДНК. Найагресивнішою формою АФК, що здатна впливати безпосередньо на молекулу ДНК, є гідроксильний радикал [79], який утворюється в клітині у реакції Фентона (Fe2+ + H2O2 ^ ^ Fe2+ + OH + OH-) та Хабера—Вейса (O2^ + + H2O2 ^ O2 + OH + OH-) [80]. З іншого боку, зростання концентрації NO в клітині разом із супероксидом під дією РЧВ може призвести до утворення іншої АФК — пероксинітриту (ONOO-), який також може спричинювати ушкодження ДНК [81].
Індукція вільних радикалів під дією РЧВ та сигнальні каскади клітини
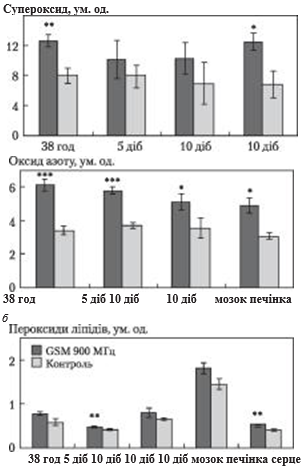
Рис. 1. Дія мікрохвильового випромінювання (GSM 900 МГц, 0,25 мкВт/см2, 158 год; n = 5—7; M±m; ум.од.) на клітини перепелиних ембріонів: а — швидкість генерування супероксидного радикала; б — швидкість генерування NO; в — рівень пероксидів ліпідів [44, 87]
Спираючись на викладені вище дані, можна стверджувати, що результатом взаємодії РЧВ живою клітиною є гіперпродукція вільних радикалів/АФК. На сьогодні зрозуміло, що вільні радикали/АФК є невід'ємною частиною сигнальних каскадів клітини [82]. Так, пероксид водню є вторинним месенджером у трансдукції інсуліну та сигнальних каскадах фактора росту [83]. Вони беруть участь у біохімічних механізмах окиснення етанолу та інших метаболічних процесах [84], а також необхідні для ініціювання репарації ран [85]. Крім того, АФК за відносно низьких концентрацій здатні регулювати перебіг запальних процесів за рахунок NF-kB [86]. Тому здатність РЧВ генерувати АФК навіть у незначній кількості може мати вагомі біологічні наслідки.
Ми показали сигнальні ефекти невеликих рівнів вільних радикалів в експериментах на перепелиних ембріонах, які піддавали опроміненню РЧВ від комерційної моделі мобільного телефону. Виявлено, що за тривалого опромінення перепелиних ембріонів in ovo спостерігається пригнічення їх розвитку [44, 87], що супроводжується значною гіперпродукцією супероксидного радикала (рис. 1а) та NO (рис. 1б), зростанням рівня пероксидного окиснення ліпідів (рис. 1в) та оксидативним ушкодженням ДНК. Водночас менш тривалеопромінення привело до стимуляції ембріонального розвитку [44, 88]. Встановлено позитивні ефекти малих доз опромінення і на молекулярному рівні. Так, короткочасне опромінення РЧВ зумовило вірогідне зменшення довжини хвоста ДНК-комет в ембріональних клітинах (рис. 2) порівняно з неопроміненим контролем, що вказує на активацію механізмів зменшення розривів ДНК. «Корисні» наслідки опромінення можна пояснити ефектом гормезису [89]. Проте можливо, що такі ефекти пояснюються сигнальною дією вільних радикалів, яка проявляється за рівнів, нижчих від тих, що можуть спричинити ушкодження. Однак до будь-якого позитивного ефекту впливу зовнішніх факторів потрібно ставитися з обережністю і намагатися мінімізувати їх, принаймні до точної оцінки віддалених наслідків.

Рис. 2. Мікрофотографії (*40) ДНК-комет перепелиних ембріонів: контроль (а); після опромінення in ovo мікрохвильовим випромінюванням (GSM 900 МГц, 0,25 мкВт/см2) протягом 38 год інкубації (б), протягом 5 діб до та 38 год інкубації (в) [88]
Загалом це дає чіткий попереджувальний сигнал про негативну дію низькоінтенсивного РЧВ на здоров’я людини, що може бути викликана як прямим оксидативним ушкодженням, так і внаслідок порушення сигнальних каскадів клітини.
Оксидативні ефекти РЧВ та неонкологічні патології
На початку 1980;х років лікарі деяких країн почали діагностувати нову патологію, названу згодом електрогіперчутливістю (ЕГЧ), на яку люди страждають унаслідок впливу РЧВ [90]. Як правило, реакція організму таких людей на випромінювання комп’ютерних моніторів, мобільних телефонів та інших електромагнітних пристроїв проявляється з боку шкіри та слизових оболонок (свербіж, печіння, біль, відчуття жару) або серцево-судинної та нервової систем. Проблема полягає в тому, що відсоток таких людей стрімко зростає: починаючи від 0,06% населення країн Європи у 1985 р. до 9—11% у 2005 р. [91]. У Швеції, наприклад, ЕГЧ є офіційно визнано патологічним станом людини.
Опитування, проведені в різних країнах, виявляють, що від 18 до 63% молоді відчувають біль у голові або вухах під час або після розмов з мобільного [8, 92]. Крім того, велику кількість психофізичних і доклінічних розладів, зокрема втому, роздратування, головний біль, порушення сну, гормональні дисбаланси, було виявлено у багатьох людей, що проживають поблизу базових станцій мобільного зв’язку [7, 93]. Алергічну реакцію на РЧВ підтверджено значним зростанням кількості мастоцитів у шкірі обличчя внаслідок дії електромагнітних пристроїв [94]. Крім того, виявлено високий рівень дегранульованих мастоцитів у шкірі людей з ЕГЧ [90]. У свою чергу, активовані мастоцити можуть виділяти гістамін та інші медіатори таких реакцій, що проявляється алергічною гіперчутливістю, свербежем, дерматозами тощо. Слід зазначити, що в алергічних реакціях важливу роль відіграють АФК. Наприклад, у разі алергічного запалення дихальних шляхів клітини легень унаслідок антигенної стимуляції генерують супероксид у наномолярних концентраціях [95]. Також мастоцити виробляють АФК унаслідок агрегації FceRI, близькоспорідненого рецептора IgE [96]. Крім того, НАДФН-оксидаза пилку швидко підвищує рівень АФК в епітелії легень [97], а видалення НАДФН-оксидази пилку із введеного матеріалу зменшує антиген-зумовлене алергічне запалення дихальних шляхів. Отже, цілком імовірно, що однією з передумов виникнення ЕГЧ є гіперпродукція АФК у клітинах унаслідок впливу РЧВ.
Оксидативні ефекти РЧВ та потенційна канцерогенність
Епідеміологічні дослідження останніх років вказують на значне зростання ризиків виникнення різних форм раку в осіб, які активно або тривалий час користуються мобільним телефоном [98]. Зокрема, у них спостерігається зростання ризиків виникнення пухлин головного мозку, неврином слухового нерва, пухлин привушної залози, семіном, меланом та лімфом [98]. Є також повідомлення про значне збільшення випадків онкозахворювань у людей, які проживають поблизу базових станцій мобільного зв’язку [99]. Крім того, в експериментальних дослідженнях було виявлено поширення різних форм раку у лабораторних тварин унаслідок довготривалої дії низькоінтенсивного РЧВ [100]. Встановлено зростання в опромінених РЧВ клітинах активності орнітиндекарбоксилази [101], яка бере участь у процесах росту та поділу клітин, її активність зростає також у пухлинних клітинах. Хоча надекспресії цього ензиму недостатньо для онкологічної трансформації, підвищення його активності стимулює розвиток пухлин з передпухлинних клітин [102].
Значна гіперпродукція АФК призводить до оксидативного стресу в клітинах, спричиняє оксидативне ушкодження ДНК, а отже, може призвести до перетворення клітин на злоякісні [80]. Відомо, що крім мутагенних ефектів АФК відіграють роль вторинного месенджера внутрішньоклітинних сигнальних каскадів, які, у свою чергу, можуть зумовити онкогенні трансформації [81]. Раніше ми [44] висунули припущення, що низькоінтенсивне РЧВ викликає дисфункцію мітохондрій, що призводить до гіперпродукції супероксиду та NO і АФК-опосередкованого мутагенезу. Відомо також, що оксидативний стрес і канцерогенез пов’язані між собою. Наприклад, оксидативний стрес, зумовлений матриксною металопротеїназою-1, бере участь як у патогенезі, так і в прогресії раку простати [103]. Крім того, гіперпродукція мітохондріальних АФК на фоні гіпоксії та/або низького рівня глюкози, що приводить до стабілізації клітин шляхом підвищеної експресії HIF-2 alpha, також може спричинювати злоякісну трансформацію [104].
Висновки
Аналіз сучасних даних щодо біологічної дії низькоінтенсивного РЧВ дає змогу зробити висновок, що цей фізичний агент є потужним оксидативним стрес-фактором для живої клітини. Оксидативні ефекти РЧВ можуть бути пов’язані зі змінами у функціонуванні ключових АФК-генеруючих систем клітин, у тому числі ЕТЛ мітохондрій та нефагоцитарних НАДН-оксидаз; безпосереднім впливом на молекули води; конформаційними змінами важливих макромолекул тощо. Значний патогенний потенціал АФК та їх участь у регуляції клітинного метаболізму пояснює широкий спектр біологічних ефектів низькоінтенсивного РЧВ, зокрема як онкологічні, так і неонкологічні патології.
References
- 1. Maes W. Stress caused by electromagnetic fields and radiation. (Neubeuern, 2005).
- 2. Hardell L., Carlberg M., Hansson M.K., Eriksson M. Case-control study on the use of mobile and cordless phones and the risk for malignant melanoma in the head and neck region. Pathophysiology. 2011. 18(4): 325.
- 3. Hardell L., Carlberg M., Soderqvist F, Mild K.H., Morgan L.L. Long-term use of cellular phones and brain tumours: increased risk associated with use for > or =10 years. Occup. Environ. Med. 2007. 64(9): 626.
- 4. Sadetzki S., Chetrit A., Jarus-Hakak A., Cardis E., Deutch Y., Duvdevani S., Zultan A., Novikov I., Freedman L., Wolf M. Cellular phone use and risk of benign and malignant parotid gland tumors — a nationwide case-control study. Am. J. Epidemiol. 2008. 167(4): 457.
- 5. Sato Y., Akiba S., Kubo O., Yamaguchi N. A case-case study of mobile phone use and acoustic neuroma risk in Japan. Bioelectromagnetics. 2011. 32(2): 85.
- 6. Abdel-Rassoul G., El-Fateh O.A., Salem M.A., Michael A., Farahat F, El-Batanouny M., Salem E. Neurobehavioral effects among inhabitants around mobile phone base stations. Neurotoxicology. 2007. 28(2): 434.
- 7. Buchner K., Eger H. Changes of Clinically Important Neurotransmitters under the Influence of Modulated RF Fields. A Long-term Study under Real-life Conditions. Umwelt-Medizin-Gesellschaft. 2011. 24(1): 44.
- 8. Chu M.K., Song H.G., Kim C., Lee B.C. Clinical features of headache associated with mobile phone use. A crosssectional study in university students. BMC Neurol. 2011. 11: 115.
- 9. Agarwal A., Desai N.R., Makker K., Varghese A., Mouradi R., Sabanegh E., Sharma R. Effects of radiofrequency electromagnetic waves (RF-EMW) from cellular phones on human ejaculated semen. An in vitro pilot study. Fertil. Steril. 2009. 92(4): 1318.
- 10. Guidelines for limiting exposure to time-varying elecrtic, magnetic and electromagnetic fields (up to 300 GHz). Health Phys. 1998. 74(4): 494.
- 11. Belyaev I. Dependence of non-thermal biological effects of microwaves on physical and biological variables. Implications for reproducibility and safety standards. Eur. J. Oncol. Library. 2010. 5: 187.
- 12. Consales C., Merla C., Marino C., Benassi B. Electromagnetic fields, oxidative stress, and neurodegeneration. Int. J. Cell Biol. 2012. 683 897.
- 13. Desai N.R., Kesari K.K., Agarwal A. Pathophysiology of cell phone radiation: oxidative stress and carcinogenesis with focus on male reproductive system. Reprod. Biol. Endocrinol. 2009. 7: 114.
- 14. Yakymenko I., Sidorik E., Tsybulin O. Metabolic changes in living cells under electromagnetic radiation of mobile communication systems. Ukrainian Biochem. J. 2011. 83(2): 5. [in Russian].
- 15. Hyland G.J. Physics and biology of mobile telephony. Lancet. 2000. 356(9244): 1833.
- 16. Gandhi O. P, Morgan L.L., de Salles A.A., Han Y.Y., Herberman R.B., Davis D.L. Exposure limits. the underestimation of absorbed cell phone radiation, especially in children. Electromagn. Biol. Med. 2012. 31(1): 34.
- 17. Panagopoulos D.J., Karabarbounis A., Margaritis L.H. Mechanism for action of electromagnetic fields on cells. Biochem. Biophys. Res. Commun. 2002. 298(1): 95.
- 18. Goodman R., Blank M. Insights into electromagnetic interaction mechanisms. J. Cell Physiol. 2002. 192(1): 16.
- 19. Blank M., Soo L. Electromagnetic acceleration of electron transfer reactions. J. Cell Biochem. 2001. 81(2): 278.
- 20. Blank M., Soo L. Electromagnetic acceleration of the Belousov-Zhabotinski reaction. Bioelectrochemistry. 2003. 61(1): 93.
- 21. Marino A.A., Carrubba S., Frilot C., Chesson A.L. Evidence that transduction of electromagnetic field is mediated by a force receptor. Neurosci. Lett. 2009. 452(2): 119.
- 22. Georgiou C.D. Oxidative stress-induced biological damage by low-level EMFs. Eur. J. Oncol. 2010. 5: 63.
- 23. Cespedes O., Ueno S. Effects of radio frequency magnetic fields on iron release from cage proteins. Bioelectromagnetics. 2009. 30(5): 336.
- 24. Zmyslony M., Politanski P, Rajkowska E., Szymczak W., Jajte J. Acute exposure to 930 MHz CW electromagnetic radiation in vitro affects reactive oxygen species level in rat lymphocytes treated by iron ions. Bioelectromagnetics. 2004. 25(5): 324.
- 25. Bohr H., Bohr J. Microwave-enhanced folding and denaturation of globular proteins. Phys. Rev. E. 2000. 61: 4310.
- 26. Budi A., Legge F.S., Treutlein H., Yarovsky I. Effect of frequency on insulin response to electric field stress. J. Phys. Chem. B. 2007. 111(20): 5748.
- 27. Pavicic I., Trosic I. Interaction of GSM modulated RF radiation and macromolecular cytoskeleton structures. In: Biological Effects of Electromagnetic Fields: Proc. 6th Int. Workshop (10—14 Oct. 2010, Bodrum, Turkey).
- 28. Hoyto A., Juutilainen J., Naarala J. Ornithine decarboxylase activity is affected in primary astrocytes but not in secondary cell lines exposed to 872 MHz RF radiation. Int. J. Radiat. Biol. 2007. 83(6): 367.
- 29. Pall M.L. Electromagnetic fields act via activation of voltage-gated calcium channels to produce beneficial or adverse effects. J. Cell. Mol. Med. 2013. 17(8): 958.
- 30. Vaks V.L., Domrachev G.A., Rodygin Y.L., Selivanovskii D.A., Spivak E.I. Dissociation of water by microwave radiation. Radiophys. Quantum Electron. 1994. 37(1): 85.
- 31. Halliwell B. Biochemistry of oxidative stress. Biochem. Soc. Trans. 2007. 35: 1147.
- 32. Halliwell B. Reactive oxygen species in living systems: source, biochemistry, and role in human disease. Am. J. Med. 91(3): 14S.
- 33. Halliwell B., Gutteridge J.M. Biologically relevant metal ion-dependent hydroxyl radical generation. FEBS Lett. 307(1): 108.
- 34. Halliwell B., Gutteridge J.M. The importance of free radicals and catalytic metal ions in human diseases. Mol. Aspects Med. 1985. 8(2): 89.
- 35. Halliwell B. Oxidants and human disease: some new concepts. FASEB J. 1987. 1(5): 358.
- 36. Gutteridge J.M. Hydroxyl radicals, iron, oxidative stress, and neurodegeneration. Ann. N. Y. Acad. Sci. 1994. 738: 201.
- 37. Feig D.I., Reid T.M., Loeb L.A. Reactive oxygen species in tumorigenesis. Cancer Res. 1994. 54: 1890s.
- 38. Mates J.M. Effects of antioxidant enzymes in the molecular control of reactive oxygen species toxicology Toxicology. 2000. 153(1): 83.
- 39. Friedman J., Kraus S., Hauptman Y., Schiff Y., Seger R. Mechanism of short-term ERK activation by electromagnetic fields at mobile phone frequencies. Biochem. J. 2007. 405(3): 559.
- 40. Griendling K.K., Sorescu D., Ushio-Fukai M. NAD (P)H oxidase. Role in cardiovascular biology and disease. Circ. Res. 2000. 86(5): 494.
- 41. Low H., Crane F.L., Morre D.J. Putting together a plasma membrane NADH oxidase. Int. J. Biochem. Cell Biol. 2012. 44(11): 1834.
- 42. Inoue M., Sato E.F., Nishikawa M., Park A.M., Kira Y., Imada I., Utsumi K. Mitochondrial generation of reactive oxygen species and its role in aerobic life. Curr. Med. Chem. 2003. 10(23): 2495.
- 43. De Iuliis G.N., Newey R.J., King B.V., Aitken R.J. Mobile phone radiation induces reactive oxygen species production and DNA damage in human spermatozoa in vitro. PLoS One. 2009. 4(7): e6446.
- 44. Burlaka A., Tsybulin O., Sidorik E., Lukin S., Polishuk V., Tsehmistrenko S., Yakymenko I. Overproduction of free radical species in embryonal cells exposed to low intensity radiofrequency radiation. Exp. Oncol. 2013. 35(3): 219.
- 45. Liu Y., Fiskum G., Schubert D. Generation of reactive oxygen species by the mitochondrial electron transport chain. J. Neurochem. 2002. 80(5): 780.
- 46. Guzy R.D., Schumacker P.T. Oxygen sensing by mitochondria at complex III: the paradox of increased reactive oxygen species during hypoxia. Exp. Physiol. 2006. 91(5): 807.
- 47. Wang X., Sharma R.K., Gupta A., George V., Thomas A.J. Jr., Falcone T., Agarwal A. Alterations in mitochondria membrane potential and oxidative stress in infertile men: a prospective observational study. Fertil. Steril. 2003. 80: 844.
- 48. Ott M., Gogvadze V, Orrenius S., Zhivotovsky B. Mitochondria, oxidative stress and cell death. Apoptosis. 2007. 12(5): 913.
- 49. Caraglia M., Marra M., Mancinelli F., D’Ambrosio G., Massa R., Giordano A., Budillon A., Abbruzzese A., Bismuto E. Electromagnetic fields at mobile phone frequency induce apoptosis and inactivation of the multi-chaperone complex in human epidermoid cancer cells. J. Cell Physiol. 2005. 204(2): 539.
- 50. Zhao T.Y., Zou S. P, Knapp PE. Exposure to cell phone radiation up-regulates apoptosis genes in primary cultures of neurons and astrocytes. Neurosci. Lett. 2007. 412(1): 34.
- 51. Yakymenko I., Tsybulin O., Sidorik E., Henshel D., Kyrylenko O., Kyrylenko S. Oxidative mechanisms of biological activity of low intensity radiofrequency radiation. Electromag. Biol. Med. 2015. PMID: 26 151 230.
- 52. Avci B., Akar A., Bilgici B., Tuncel O.K. Oxidative stress induced by 1.8 GHz radio frequency electromagnetic radiation and effects of garlic extract in rats. Int. J. Radiat. Biol. 2012. 88(11): 799.
- 53. Bilgici B., Akar A., Avci B., Tuncel O.K. Effect of 900 MHz radiofrequency radiation on oxidative stress in rat brain and serum. Electromagn. Biol. Med. 2013. 32(1): 20.
- 54. Ozguner F., Bardak Y., Comlekci S. Protective effects of melatonin and caffeic acid phenethyl ester against retinal oxidative stress in long-term use of mobile phone. A comparative study Mol. Cell Biochem. 2006. 282(1): 83.
- 55. Jelodar G., Akbari A., Nazifi S. The prophylactic effect of vitamin C on oxidative stress indexes in rat eyes following exposure to radiofrequency wave generated by a BTS antenna model. Int. J. Radiat. Biol. 2013. 89(2): 128.
- 56. Oral B., Guney M., Ozguner F., Karahan N., Mungan T., Comlekci S., Cesur G. Endometrial apoptosis induced by a 900-MHz mobile phone: preventive effects of vitamins E and C. Adv. Ther. 2006. 23(6): 957.
- 57. Turker Y., Naziroglu M., Gumral N., Celik O., Saygin M., Comlekci S., Flores-Arce M. Selenium and L-carnitine reduce oxidative stress in the heart of rat induced by 2.45-GHz radiation from wireless devices. Biol. Trace Elem. Res. 2011. 143(3): 1640.
- 58. Oksay T., Naziroglu M., Dogan S., Guzel A., Gumral N., Ko§ ar P.A. Protective effects of melatonin against oxidative injury in rat testis induced by wireless (2.45 GHz) devices. Andrologia. 2014. 46(1): 65.
- 59. Guidelines on limits of exposure to static magnetic fields. Health Phys. 2009. 96: 504.
- 60. Hong M.N., Kim B.C., Ko Y.G., Lee Y.S., Hong S.C., Kim T., Pack J.K., Choi H.D., Kim N., Lee J.S. Effects of 837 and 1950 MHz radiofrequency radiation exposure alone or combined on oxidative stress in MCF10A cells. Bioelectromagnetics. 2012. 33(7): 604.
- 61. Kang K.A., Lee H.C., Lee J.J., Hong M.N., Park M.J., Lee Y.S., Choi H.D., Kim N., Ko Y.G., Lee J.S. Effects of combined radiofrequency radiation exposure on levels of reactive oxygen species in neuronal cells. J. Radiat. Res. 2014. 55(2): 265.
- 62. Luukkonen J., Hakulinen P., Maki-Paakkanen J., Juutilainen J., Naarala J. Enhancement of chemically induced reactive oxygen species production and DNA damage in human SH-SY5Y neuroblastoma cells by 872 MHz radiofrequency radiation. Mutat. Res. 2009. 662(1): 54.
- 63. Ruediger H.W. Genotoxic effects of radiofrequency electromagnetic fields. Pathophysiology. 2009. 16: 89.
- 64. Garaj-Vrhovac V., Fucic A., Horvat D. The correlation between the frequency of micronuclei and specific chromosome aberrations in human lymphocytes exposed to microwave radiation in vitro. Mutat. Res. 1992. 281(2): 181.
- 65. Tice R.R., Hook G.G., Donner M., McRee D.I., Guy A.W. Genotoxicity of radiofrequency signals. I. Investigation of DNA damage and micronuclei induction in cultured human blood cells. Bioelectromagnetics. 2002. 23(2): 113.
- 66. Zotti-Martelli L., Peccatori M., Maggini V., Ballardin M., Barale R. Individual responsiveness to induction of micronuclei in human lymphocytes after exposure in vitro to 1800-MHz microwave radiation. Mutat. Res. 2005. 582(1): 42.
- 67. Garson O.M., McRobert T.L., Campbell L.J., Hocking B.A., Gordon I. A chromosomal study of workers with longterm exposure to radio-frequency radiation. Med. J. Aust. 1991. 155(5): 289.
- 68. Kerbacher J.J., Meltz M.L., Erwin D.N. Influence of radiofrequency radiation on chromosome aberrations in CHO cells and its interaction with DNA-damaging agents. Radiat. Res. 1990. 123(3): 311.
- 69. Maes A., Collier M., Verschaeve L. Cytogenetic investigations on microwaves emitted by a 455.7 MHz car phone. Folia Biol. 2000. 46(5): 175.
- 70. Baohong W., Jiliang H., Lifen J., Deqiang L., Wei Z., Jianlin L., Hongping D. Studying the synergistic damage effects induced by 1.8 GHz radiofrequency field radiation (RFR) with four chemical mutagens on human lymphocyte DNA using comet assay in vitro. Mutat. Res. 2005. 578(1): 149.
- 71. Belyaev I.Y., Koch C.B., Terenius O., Roxstrom-Lindquist K., Malmgren L.O., Sommer W.H., Salford L.G., Persson B.R. Exposure of rat brain to 915 MHz GSM microwaves induces changes in gene expression but not double stranded DNA breaks or effects on chromatin conformation. Bioelectromagnetics. 2006. 27(4): 295.
- 72. Diem E., Schwarz C., Adlkofer F., Jahn O., Rudiger H. Non-thermal DNA breakage by mobile-phone radiation (1800 MHz) in human fibroblasts and in transformed GFSH-R17 rat granulosa cells in vitro. Mutat. Res. 2005. 583(2): 178.
- 73. Kim J.Y., Hong S.Y., Lee Y.M., Yu S.A., Koh W.S., Hong J.R., Son T., Chang S.K., Lee M. In vitro assessment of clastogenicity of mobile-phone radiation (835 MHz) using the alkaline comet assay and chromosomal aberration test. Environ. Toxicol. 2008. 23(3): 319.
- 74. Lai H., Singh N.P. Singleand double-strand DNA breaks in rat brain cells after acute exposure to radiofrequency electromagnetic radiation. Int. J. Radiat. Biol. 1996. 69(4): 513.
- 75. Liu C., Duan W., Xu S., Chen C., He M., Zhang L., Yu Z., Zhou Z. Exposure to 1800 MHz radiofrequency electromagnetic radiation induces oxidative DNA base damage in a mouse spermatocyte-derived cell line. Toxicol. Lett. 2013. 218(1): 2.
- 76. Guler G., Tomruk A., Ozgur E., Sahin D., Sepici A., Altan N., Seyhan N. The effect of radiofrequency radiation on DNA and lipid damage in female and male infant rabbits. Int. J. Radiat. Biol. 2012. 88(4): 367.
- 77. Khalil A.M., Gagaa M.H., Alshamali A.M. 8-Oxo-7,8-dihydro-2'-deoxyguanosine as a biomarker of DNA damage by mobile phone radiation. Hum. Exp. Toxicol. 2012. 31(7): 734.
- 78. Xu S., Zhou Z., Zhang L., Yu Z., Zhang W., Wang Y., Wang X., Li M., Chen Y., Chen C., He M., Zhang G., Zhong M. Exposure to 1800 MHz radiofrequency radiation induces oxidative damage to mitochondrial DNA in primary cultured neurons. Brain Res. 2010. 1311: 189.
- 79. Halliwell B. Oxidative stress and cancer. Have we moved forward? Biochem. J. 2007. 401(1): 1.
- 80. Valko M., Leibfritz D., Moncol J., Cronin M.T., Mazur M., Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int. J. Biochem. Cell Biol. 2007. 39(1): 44.
- 81. Valko M., Rhodes C.J., Moncol J., Izakovic M., Mazur M. Free radicals, metals and antioxidants in oxidative stressinduced cancer. Chem. Biol. Interact. 2006. 160(1): 1.
- 82. Forman H.J., Ursini F, Maiorino M. An overview of mechanisms of redox signaling. J. Mol. Cell. Cardiol. 2014. 73(2): 9.
- 83. Sies H. Role of metabolic H2O2 generation: redox signaling and oxidative stress. J. Biol. Chem. 2014. 289(13): 8735.
- 84. Oshino N., Jamieson D., Sugano T., Chance B. Optical measurement of the catalase-hydrogen peroxide intermediate (Compound I) in the liver of anaesthetized rats and its implication to hydrogen peroxide production in situ. Biochem. J. 1975. 146(1): 67.
- 85. Enyedi B., Niethammer P. H2O2 a chemoattractant? Methods Enzymol. 2013. 528: 237.
- 86. Hayden M.S., Ghosh S. NF-kappaB in immunobiology. Cell Res. 2011. 21(2): 223.
- 87. Tsybulin O., Sidorik E., Kyrylenko S., Henshel D., Yakymenko I. GSM 900 MHz microwave radiation affects embryo development of Japanese quails. Electromagn. Biol. Med. 2012. 31(1): 75.
- 88. Tsybulin O., Sidorik E., Brieieva O., Buchynska L., Kyrylenko S., Henshel D., Yakymenko I. GSM 900 MHz cellular phone radiation can either stimulate or depress early embryogenesis in Japanese quails depending on the duration of exposure. Int. J. Radiat. Biol. 2013. 89(9): 756.
- 89. Calabrese E.J. Hormesis: why it is important to toxicology and toxicologists. Environ. Toxicol. Chem. 2008. 27(7): 1451.
- 90. Johansson O. Electrohypersensitivity: state-of-the-art of a functional impairment. Electromagn. Biol. Med. 2006. 25(4): 245.
- 91. Hallberg O., Oberfeld G. Letter to the editor: Will we all become electrosensitive? Electromagn. Biol. Med. 2006. 25(3): 189.
- 92. Yakymenko I., Sidorik E., Tsybulin O., Chekhun V. Potential risks of microwaves from mobile phones for youth health. Environ. Health. 2011. 56: 48.
- 93. Santini R., Santini P, Danze J.M., Ruz P.L., Seigne M. Study of the health of people living in the vicinity of mobile phone base stations. Influences of distance and sex. Pathol. Biol. 2002. 50(6): 369.
- 94. Johansson O., Gangi S., Liang Y., Yoshimura K., Jing C., Liu P-Y. Cutaneous mast cells are altered in normal healthy volunteers sitting in front of ordinary TVs/PCs — results from open-field provocation experiments. J. Cutan. Pathol. 2001. 28(10): 513.
- 95. Nagata M. Inflammatory cells and oxygen radicals. Curr. Drug Targets Inflamm. Allergy. 2005. 4(4): 503.
- 96. Okayama Y. Oxidative stress in allergic and inflammatory skin diseases. Curr. Drug Targets Inflamm. Allergy. 2005. 4(4): 517.
- 97. Boldogh I., Bacsi A., Choudhury B.K., Dharajiya N., Alam R., Hazra T.K., Mitra S., Goldblum R.M., Sur S. ROS generated by pollen NADPH oxidase provide a signal that augments antigen-induced allergic airway inflammation. J. Clin. Invest. 2005. 115(8): 2169.
- 98. Yakymenko I., Sidorik E., Kyrylenko S., Chekhun V. Long-term exposure to microwave radiation provokes cancer growth: evidences from radars and mobile communication systems. Exp. Oncol. 2011. 33(2): 62.
- 99. Wolf R., Wolf D. Increased incidence of cancer near a cell-phone transmitter station. In: Trends in cancer prevention. (Nova Sci. Pub. Inc., 2007).
- 100. Repacholi M.H., Basten A., Gebski V., Noonan D., Finnie J., Harris A.W. Lymphomas in E mu-Pim1 transgenic mice exposed to pulsed 900 MHz electromagnetic fields. Radiat. Res. 1997. 147(5): 631.
- 101. Hoyto A., Juutilainen J., Naarala J. Ornithine decarboxylase activity of L929 cells after exposure to continuous wave or 50 Hz modulated radiofrequency radiation — a replication study. Bioelectromagnetics. 2007. 28(7): 501.
- 102. Clifford A., Morgan D., Yuspa S.H., Soler A. P, Gilmour S. Role of ornithine decarboxylase in epidermal tumorigenesis. Cancer Res. 1995. 55(8): 1680.
- 103. Nguyen H.L., Zucker S., Zarrabi K., Kadam P, Schmidt C., Cao J. Oxidative stress and prostate cancer progression are elicited by membrane-type 1 matrix metalloproteinase. Mol. Cancer Res. 2011. 9(10): 1305.
- 104. Ralph S.J., Rodriguez-Enriquez S., Neuzil J., Saavedra E., Moreno-Sanchez R. The causes of cancer revisited. «Mitochondrial malignancy» and ROS-induced oncogenic transformation. Why mitochondria are targets for cancer therapy. Mol. Aspects Med. 2010. 31(2): 145.